

O câncer de próstata é o segundo câncer mais diagnosticado no homem (câncer de pele não melanoma é o primeiro), com a estimativa de 1,4 milhões de diagnósticos e responsável por 375 mil mortes ao ano pelo mundo. Estudos em análises de próstatas em autópsias de homens mostram que o câncer de próstata pode ocorrer em todas as idades, sendo muito raro em indivíduos jovens (< 40 anos) e alcançando uma prevalência de aproximadamente 60% em indivíduos maiores do que 79 anos.
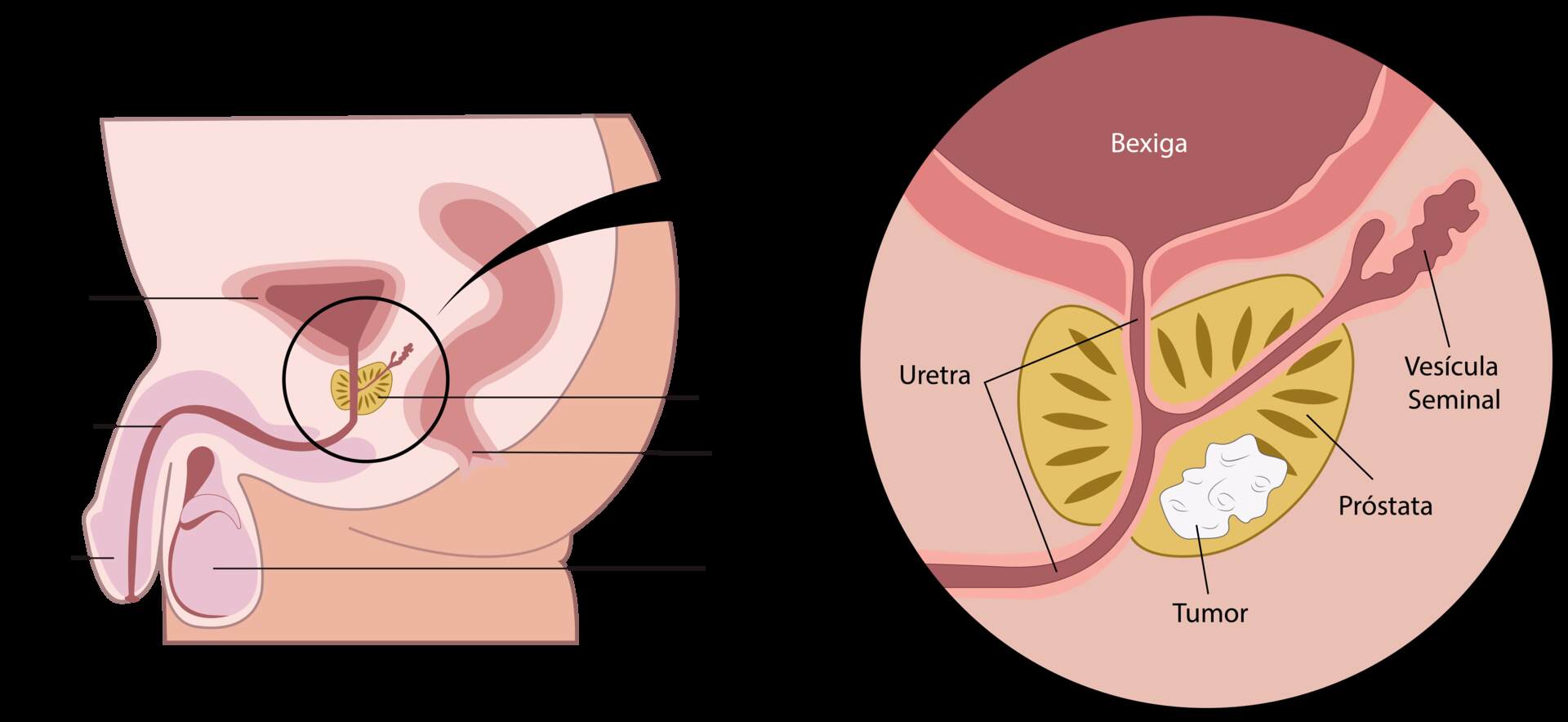
Localização da Próstata e do Câncer de Próstata
Além da idade, fatores étnicos, socioeconômicos, comorbidades (síndrome metabólica e obesidade), estilo de vida (dieta, exposição ocupacional a agentes específicos e tabagismo) e genéticos também apresentam impacto quanto a variabilidade da incidência e agressividade do câncer na próstata.
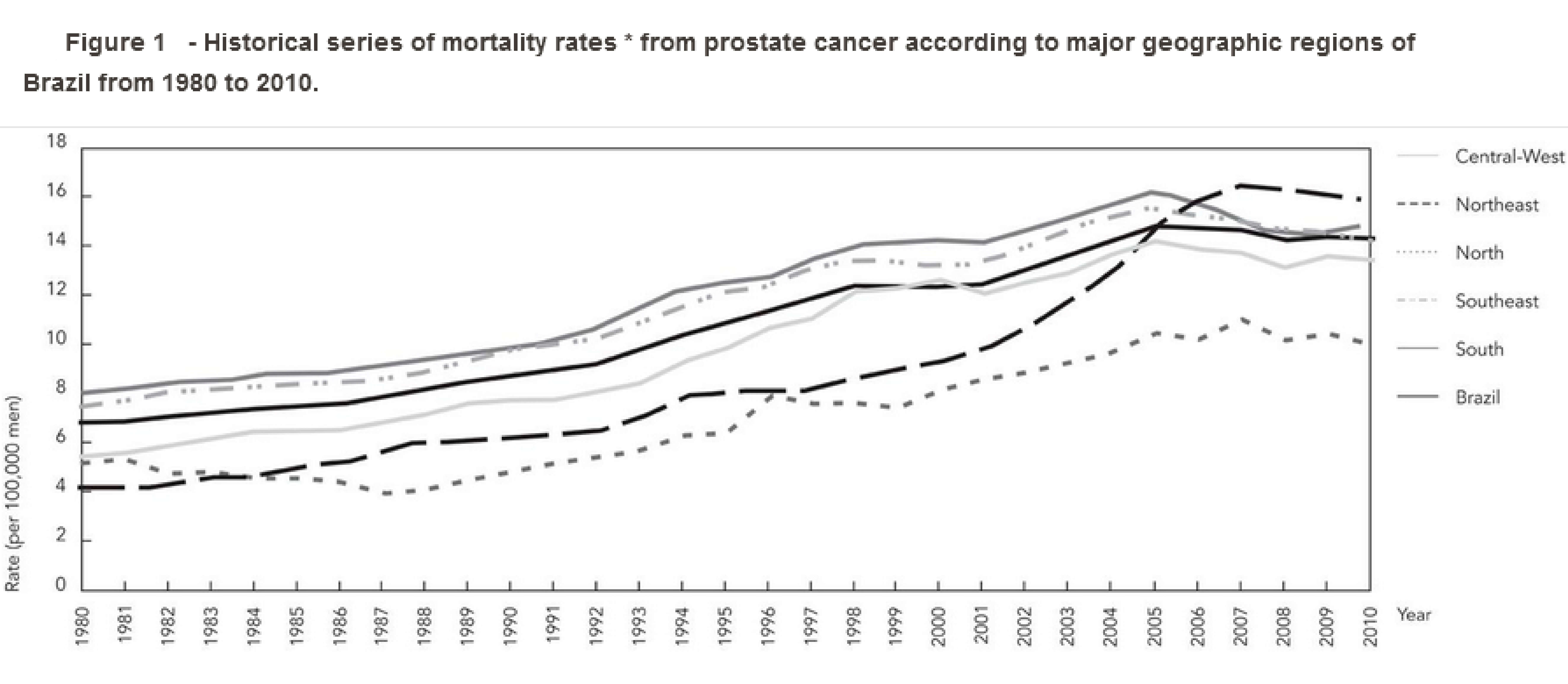
Gráfico mostrando a incidência de câncer de próstata ao longo dos anos no Brasil (https://www.scielosp.org/article/csp/2014.v30n3/559-566/)
Os sintomas do câncer de próstata geralmente ocorrem em doenças localmente avançadas ou metastáticas, sendo raros os sintomas na fase inicial.
A correta maneira de realizar a detecção precoce do adenocarcinoma de próstata (muito conhecido como rastreio ou screening) é um grande tema de debate médico e sofreu modificações ao longo dos anos. Inicialmente a avaliação da próstata era exclusivamente feita pelo exame de toque retal, onde pela sua localização anatômica, é possível palpar a superfície da próstata e identificar nódulos suspeitos. Na década de 70 o antígeno prostático específico (PSA) foi descoberto e revolucionou a detecção do câncer na próstata.
O PSA consiste em uma proteína produzida pelo tecido prostático e pode apresentar valores aumentados na presença da neoplasia maligna da próstata. Estudos provenientes da década de 90 mostraram que até 43% dos diagnósticos de câncer na próstata em estado intermediário não seriam detectados exclusivamente com o exame de toque retal associados ao ultrassom da próstata, mostrando a sua importância clínica. No entanto, com o entendimento melhor do comportamento e evolução natural da neoplasia de próstata, descobre-se que a doença pode apresentar características e agressividades diferentes, sendo que, em alguns casos, a possibilidade da doença se tornar clinicamente significativa (isto é, capacidade de apresentar problemas ao paciente caso não for tratado) pode ocorrer em torno de 10 ou 15 anos.
Sendo assim, existe uma recomendação atual para não se realizar o uso indiscriminado do PSA no rastreio da neoplasia prostática e saber como interpretá-lo corretamente junto a outros fatores, como a idade do paciente, doenças pré-existentes, influência genética, densidade do PSA, aumento com relação ao tempo, e etc, e assim entender se cabe seguir a investigação com ressonância multiparamétrica ou biopsia da próstata e estabelecer o intervalo correto de reavaliar o paciente. Portanto, o conceito de individualização do paciente é cada vez mais adotado. O urologista deve realizar uma avaliação específica de cada um e propor a melhor via de rastreio e seguimento conforme os aspectos citados anteriormente.
| Recomendação para avaliação inicial de rastreio no câncer de próstata |
|---|
| Homens com mais de 50 anos; |
| Homens com 45 anos afrodescendentes ou com histórico familiar; |
| Homens com 40 anos e portadores de mutações genéticas (BRCA2); |
A ressonância da próstata é um exame que vem revolucionando tanto o diagnóstico como o seguimento dos pacientes com suspeita de câncer de próstata. O exame consiste na aquisição de imagens da pelve e da próstata através de tecnologia eletromagnética.
O paciente necessita estar em algumas horas de jejum conforme orientação da instituição que irá realizar o exame. O mesmo é inserido dentro da máquina (que se assemelha a um túnel) e deve permanecer imóvel por cerca de 45 minutos onde as imagens serão captadas. Eventualmente pode ser necessário o uso de contraste para melhor aquisição das imagens. Após o exame, o paciente pode retornar às suas atividades diárias. Cabe ressaltar que existem pacientes que possuem contra-indicações absolutas e relativas para a realização do exame, como implantes de metais no corpo (próteses e órteses), gestação e condições cardíacas e pulmonares de maior gravidade. Paciente com dificuldade de realizar o exame por mal estar e histórico de claustrofobia podem necessitar de sedação quando disponível.
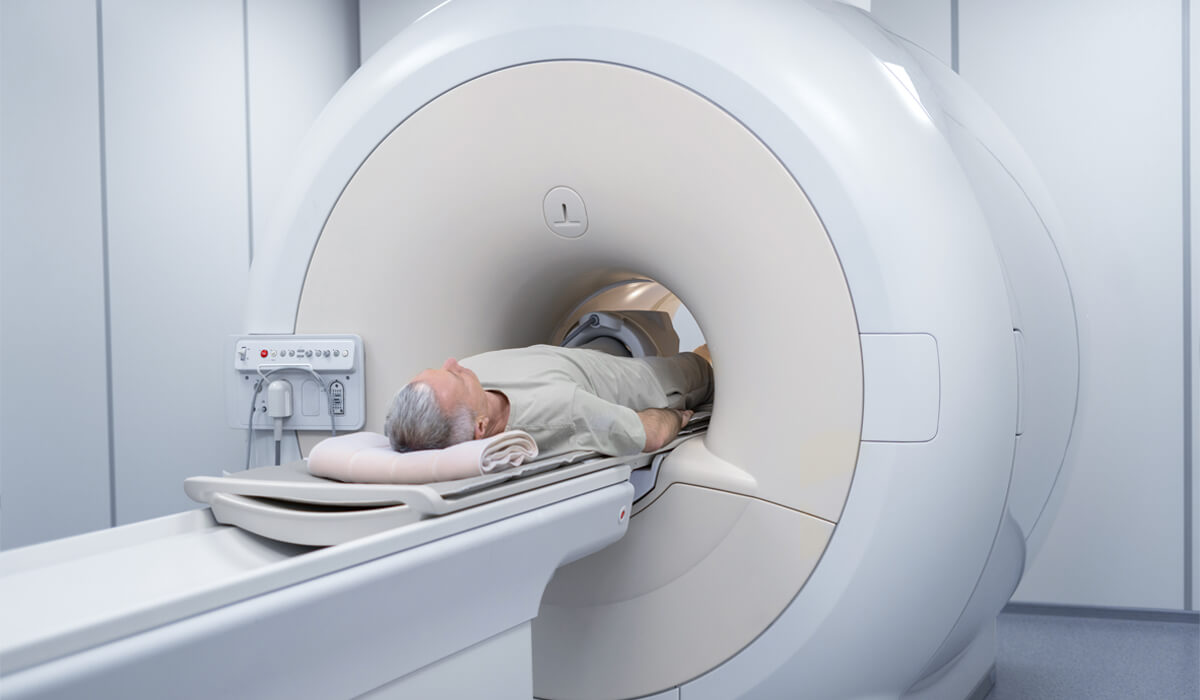
Paciente posicionado para a ressonância de próstata
Através da RNM da próstata podemos identificar a possibilidade de uma lesão na próstata ser sugestiva de tumor (classificação de PIRADS), guiar a biópsia da próstata com focos em áreas suspeitas, grau de extensão local da doença, otimizar o planejamento cirúrgico e estabelecer protocolos de seguimento. Sendo assim, é um exame que traz muitos recursos e é sempre indicado quando possível realizá-lo.
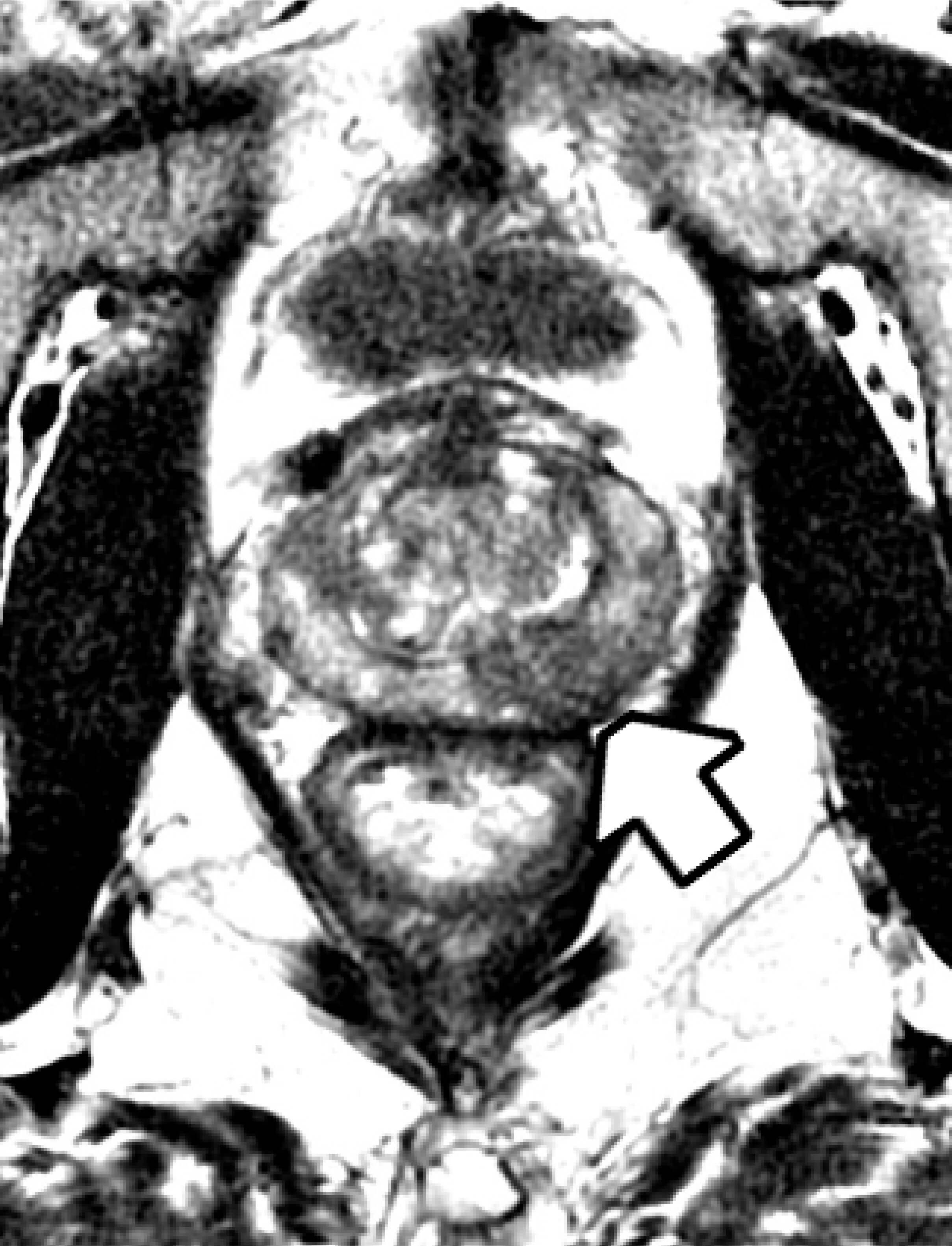
Área suspeita de câncer de próstata (setas brancas)
| Classificação de PIRADS e probabilidade de doença clinicamente significativa: |
|---|
| PIRADS 1: Muito pouco provável (<5%) |
| PIRADS 2: Pouco provável (5 - 15%) |
| PIRADS 3: Risco intermediario (20 - 50%) |
| PIRADS 4: Probabilidade elevada (51 - 80%) |
| PIRADS 5: Muito provável (> 80%) |
A avaliação inicial do rastreio da neoplasia prostática guia o paciente e o urologista quanto a probabilidade de ser detectado um câncer clinicamente significativo onde seja necessário tratamento, porém o diagnóstico é de fato apenas estabelecido com a identificação da patologia do câncer, retirado através da biópsia da próstata.
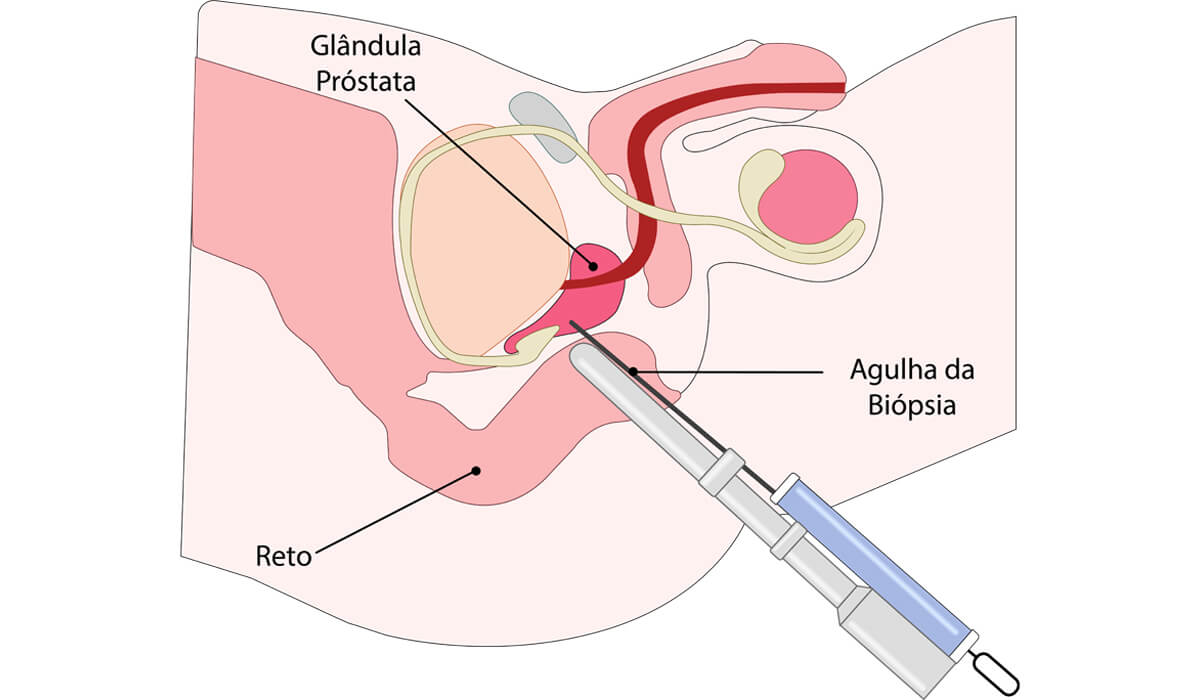
Como é feita a biópsia de próstata
A biópsia da próstata é feita sob anestesia local ou geral, onde por meio de uma agulha e guiado por ultrassom são retirados múltiplos fragmentos da próstata e assim identificado o tecido que apresenta alterações causadas pelo tumor.
A extração dos fragmentos possui técnicas e vias de realização distintas. O tipo de extração dos fragmentos pode ser apenas sistêmico (isto é, setorizando a próstata e tirando fragmentos em cada região padronizada) ou direcionada em setores específicos através do toque retal ou pareando com a ressonância magnética da próstata (esta última conhecida como biópsia por fusão de imagens, onde o profissional que está realizando a biópsia da próstata sobrepõe as imagens da ressonância ao ultrassom).
O tipo de acesso da biópsia pode ser realizado com a retirada dos fragmentos via transretal ou transperineal. O primeiro é o mais frequente e consiste na colocação do transdutor através do reto e feita punções com agulha fina para retirada dos fragmentos. Já no segundo, o transdutor também é acoplado através do reto porém as punções são feitas através da pele entre a região do canal anal e da raiz do escroto (região do períneo). Estudos mostram que este último tem a premissa de trazer menos complicações e infecções, porém ainda é pouco disponível na rede hospitalar.
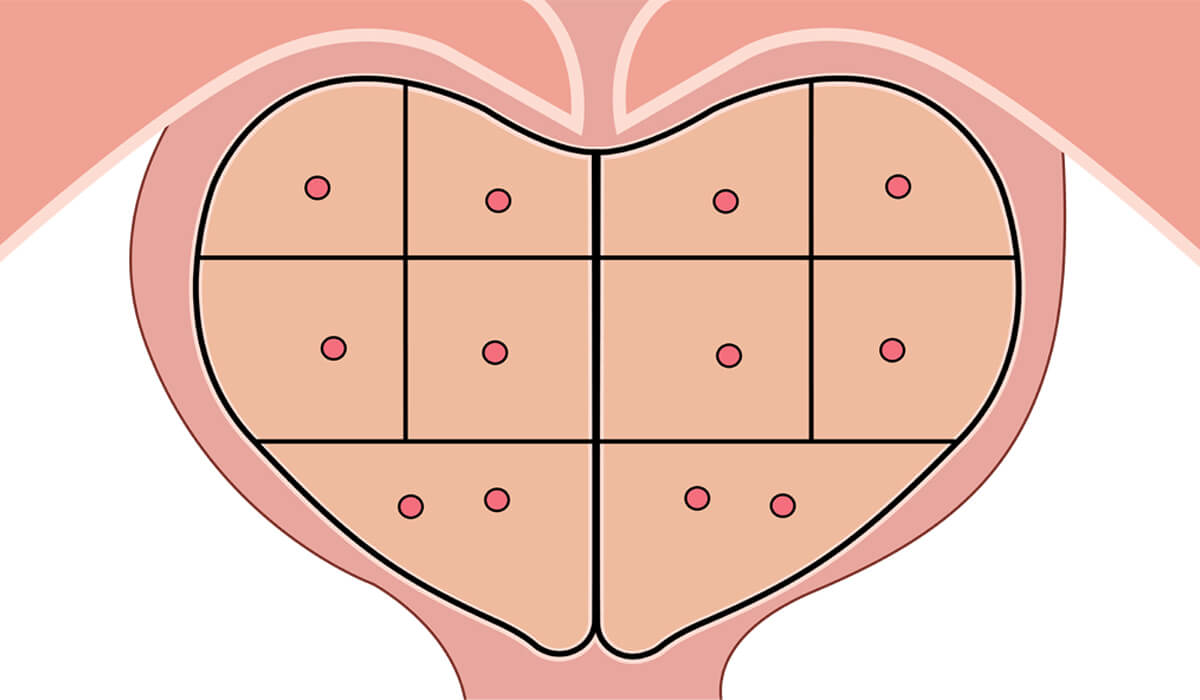
Próstata com os setores diferenciados de retirada dos fragmentos
A pontuação de gleason surgiu na década de 60 e vem sendo utilizada desde então. Tem como princípio agrupar achados patológicos em setores semelhantes e padronizá-los em 5 níveis. O nível 1 é o menos agressivo, muito semelhante às células de uma próstata sadia, enquanto o nível 5 é o mais agressivo e apresenta células muito distantes do padrão de células saudáveis da próstata (mais indiferenciados, na análise médica). A pontuação final é dada pelos dois subtipos mais prevalentes na próstata analisada. Por exemplo, se estamos diante de um câncer de próstata gleason 7 (4 + 3), sabemos que o subtipo 4 é o mais prevalente e o subtipo 3 é o segundo mais prevalente.
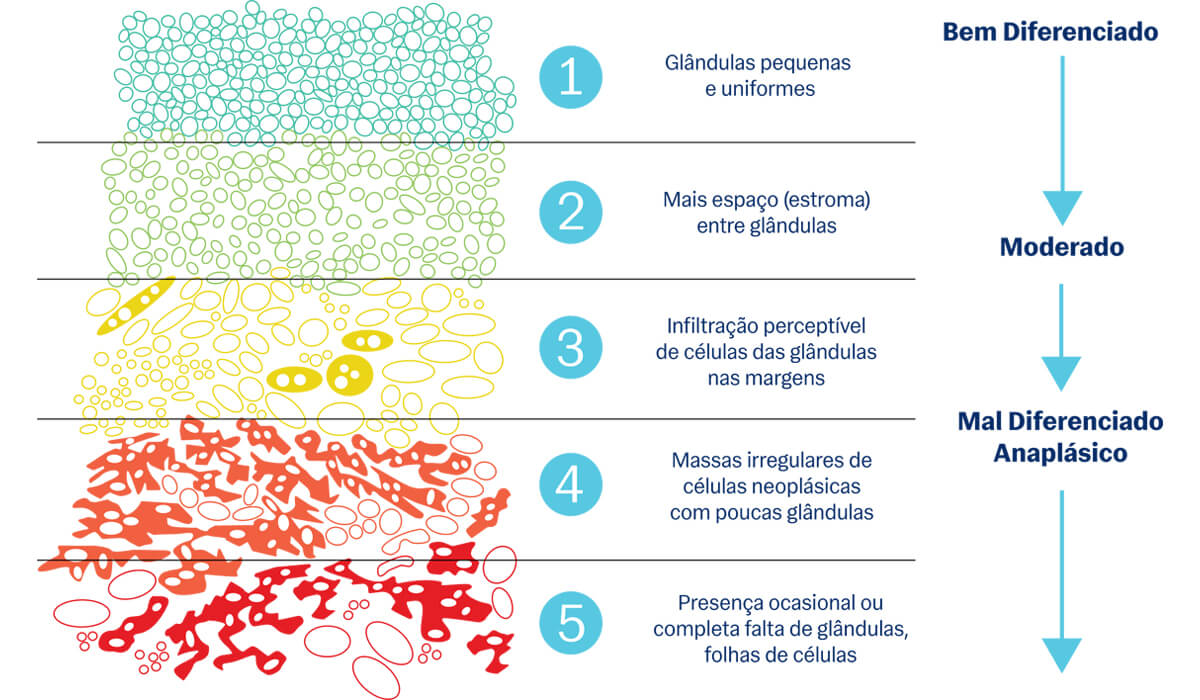
Pontuação de gleason, do achado mais indolente (tipo 1) até o mais agressivo (tipo 5), mostrando as alterações celulares identificadas
Com essa diferenciação, podemos interpretar a agressividade da neoplasia prostática (tanto com progressão para tecidos locais como a distância), o prognóstico, tipo de tratamento do câncer de próstata necessário e o acompanhamento subsequente.
É muito comum o paciente de maneira errada associar que próstata aumentada é câncer. O que ocorre é que a próstata aumentada em sua enorme maioria decorre da hiperplasia prostática, uma alteração benigna que leva ao crescimento do tamanho da próstata. Após a avaliação adequada, o médico que cuida da próstata saberá discernir um quadro do outro e direcionar para o tratamento adequado em cada caso.
Os tratamentos para câncer de próstata dependem de fatores da própria doença diagnosticada como do próprio paciente, visto seus padrões patológicos apresentarem agressividade e capacidade de progressão distintas. Dependendo do grau da neoplasia prostática, pode ser necessário exames para investigação de progressão local (como a ressonância multiparamétrica da próstata) e a distância (Tomografia de abdome, pelve e tórax; cintilografia óssea, PET PSMA, etc). Devido a série de tratamentos disponíveis e com estes riscos e benefícios distintos, não só o urologista como o próprio paciente também têm papel fundamental para escolher a opção de tratamento do câncer de próstata que mais o agrada. Sendo assim, é importante ressaltar que o câncer de próstata tem cura dependendo de seu quadro inicial e apresenta múltiplas opções de tratamento.
Usado para neoplasia prostática em estágio precoce e menos agressivo. O paciente é avaliado continuamente com PSA, exame de toque retal, RNM e biópsia de próstata com o intuito de evitar a realização de tratamentos mais agressivos e assim evitar os seus efeitos colaterais.
Na eventualidade de alteração do padrão do adenocarcinoma de próstata durante o acompanhamento, a vigilância ativa deixa de ser opção.
O tratamento do câncer de próstata ocorre por meio de ondas de radiação externas à pelve, sendo direcionadas exclusivamente ao campo da próstata ou por meio de implantes colocados via transretal (braquiterapia) que emite as ondas de radiação mais localizadas.
A prostatectomia radical consiste em um dos tratamentos mais disponíveis e empregados para o tratamento do câncer de próstata na doença localizada, recebendo muitos aprimoramentos ao longo dos anos.
Resumidamente, o procedimento ocorre pela retirada da próstata, vesículas seminais, tecidos adjacentes quando acometidos por tumor e eventualmente retirada de gânglios linfáticos abdominais.
Os acessos podem ser por cirurgia aberta, laparoscópica e robótica, sendo a última cada vez mais empregada e disponível, visto o ganho cirúrgico e funcional que a tecnologia trouxe.
A primeira cirurgia de próstata robótica no mundo foi feita em 2001 e desde então seus benefícios ficaram claros e se tornou cada vez mais a realidade do urologista. Por meio de 5 acessos menores de 1 cm, o cirurgião se utiliza da interface robótica onde as pinças cirúrgicas são acopladas na cavidade abdominal e assim a próstata é retirada e a reconstrução da bexiga a uretra (canal que leva a urina ao meio externo) é feita.
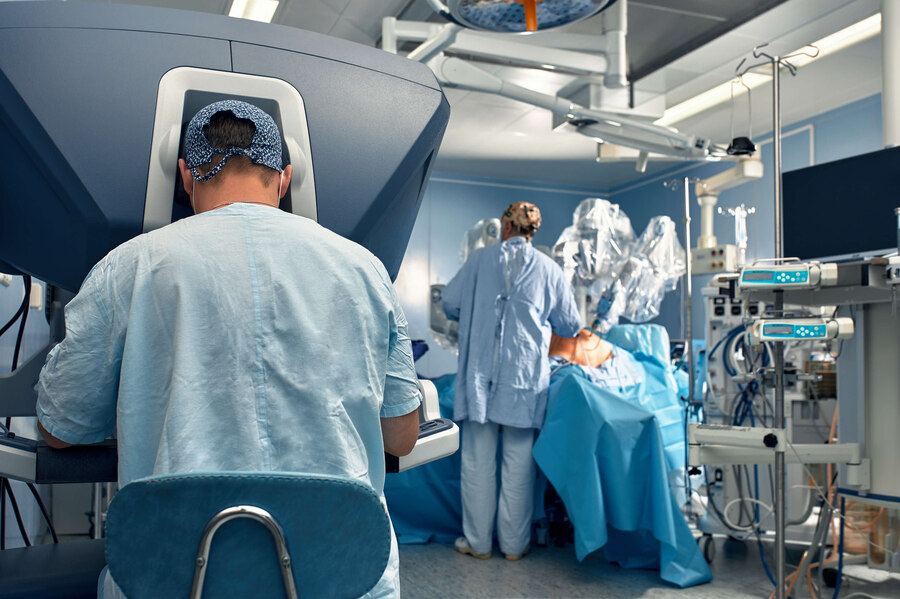
Disposição da sala para cirurgia robótica. Cirurgião no console. Equipe dentro de campo manipulando os braços robóticos
Console do Robô
Braço do Robô
Cirurgião no console durante prostatectomia radical robótica
A capacidade de ampliação da imagem (30x comparado a visão tradicional) atrelada a rapidez e amplitude dos movimentos que as pinças robóticas conferem trouxe bons resultados funcionais, menores taxas de complicações no intra e pós operatório e mantendo o adequado o controle oncológico comparado às técnicas pregressas da prostatectomia radical.
| Probabilidade do evento | PR (%) | PL (%) | PA (%) |
|---|---|---|---|
| Estreitamento da anastomose | 1.0 | 2.1 | 4.9 |
| Vazamento das anastomose | 1.0 | 4.4 | 3.3 |
| Infecção | 0.8 | 1.1 | 4.8 |
| Lesão no orgão adjacente | 0.4 | 2.9 | 0.8 |
| Trombose | 0.6 | 0.2 | 1.4 |
PR = Prostatectomia Robotica; PL = Prostatectomia Laparoscopica; PA = Prostatectomia aberta.European Association of Urology, 2021
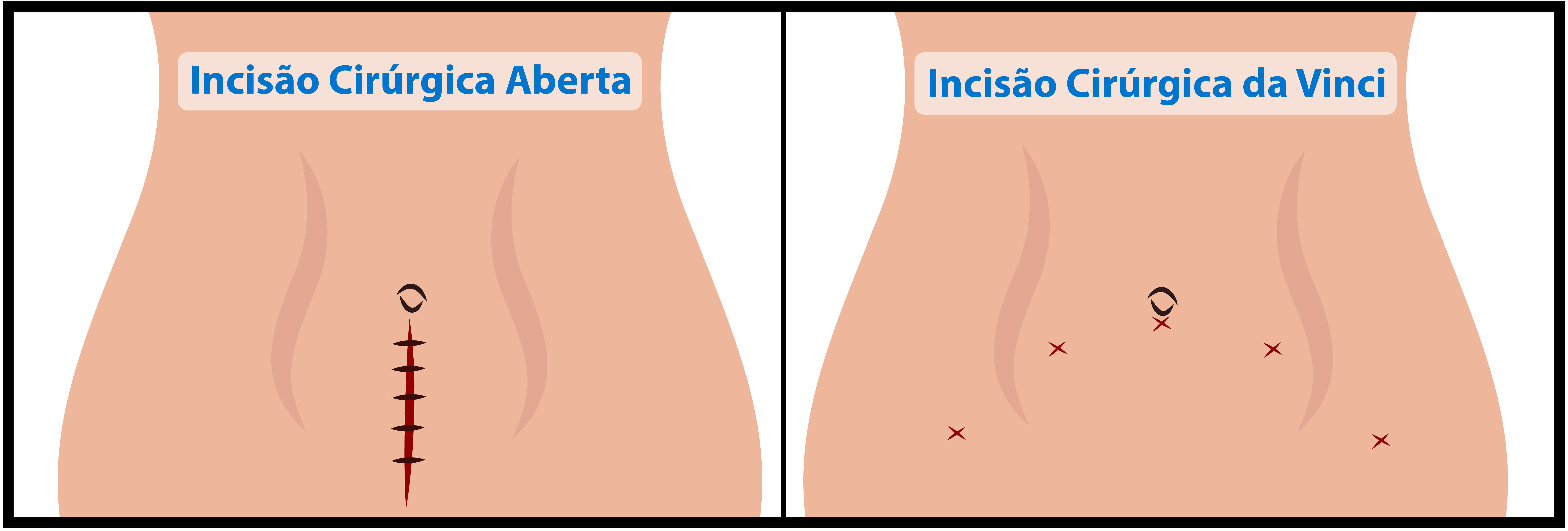
Comparativo entre o tamanho da incisão na cirurgia aberta x cirurgia robótica
Estudos recentes comparando resultados de pacientes submetidos a prostatectomia aberta e robótica têm mostrado um benefício mais claro da segunda, com relação a estabilização da continência e retomada da função erétil. A taxa de continência na prostatectomia robótica pode ser próxima a 95% em 18 meses após a cirurgia, sendo que estudos analisando a continência com a cirurgia aberta podem chegar a 78%.
A potência erétil pode ser satisfatoriamente preservada entre 60 - 90%, com estabilização mais clara após 1 a 2 anos da cirurgia. São vários os fatores que podem levar a um melhor restabelecimento da continência e da potência erétil após a prostatectomia. Não só a preservação dos nervos e estruturas adjacentes à próstata (possível de acontecer quando não houver extensão da doença fora da próstata) como também idade, comorbidades do doente, continência e potência erétil antes da cirurgia de próstata.
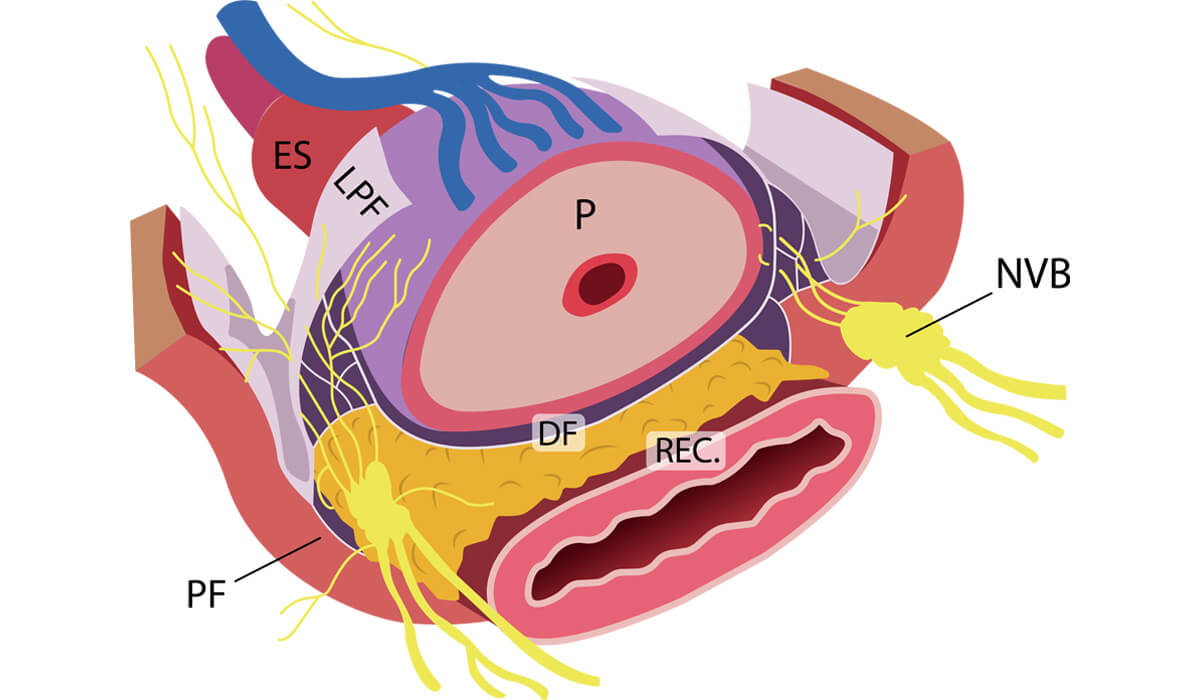
Ilustração da próstata e sua relação com os nervos responsáveis pela função erétil e continência.
P: próstata; NVB: nervos responsáveis pela continência e ereção; ES: esfíncter externo
Terapias capazes de reduzir os andrógenos circulantes no organismo, os quais são responsáveis pela progressão do câncer de próstata.
O tratamento do câncer de próstata nesse caso pode ser medicamentoso. Alguns exemplos mais prevalentes no mercado são: Leuprorrelina, Goserelina (zoladex), Degarelix, Bicalutamida (Casodex), Enzalutamida, Apalutamida, etc. Também pode ser cirurgia, com a retirada do testiculo masculino (Orquiectomia bilateral).
Consiste no tratamento do câncer de próstata com medicamentos para casos de doenças metastáticas já diagnosticadas com grande volume ou que não responderam a terapia de privação androgênica (são os chamados câncer na próstata castração resistentes). Alguns exemplos dessas classes de medicamentos são: Docetaxel (quimioterapia), Olaparibe (inibidores da PARP), Pembrolizumabe (Keytruda), etc.
Importante ressaltar que algumas dessas novas classes de medicamentos ainda estão em estudos e avaliação de sobrevida no tratamento do câncer de próstata, porém apresentam resultados promissores.
Em casos específicos, dependendo do volume de doença, localização das metástases e condições do paciente, é possível realizar um tratamento de câncer de próstata multi assistencial com a combinação entre cirurgia, radioterapia e/ou tratamento medicamentoso.
O tratamento é decidido em conjunto com a oncologia, urologia, radioterapia e demais especialidades envolvidas.
Existem outras formas de tratamento do câncer de próstata ainda em aprovação no Brasil e restritas a centros de pesquisa, como o HIFU (high intensity focused ultrasound) e a crioterapia.
Seu intuito é trazer o tratamento minimamente invasivo aos tumores localizados, porém ainda necessitam de estudos robustos de segurança e eficiência de controle da doença a longo prazo e aprovação no território brasileiro.
Apesar do incidente no homem, a neoplasia maligna da próstata possui tempo de sobrevida global muito favorável comparativamente às outras neoplasias, principalmente quando ocorre o tratamento para câncer de próstata corretamente na doença localizada. A sobrevida global na doença localizada é em torno de 98 - 99% nos estudos avaliados em 5 anos após o tratamento inicial. Já no câncer de próstata com metástase o valor pode chegar a 30 - 35%, visto a variação no grau de agressividade que pode apresentar ao diagnóstico.
Com relação à sobrevida livre de doença (isto é, capacidade de evitar recidiva da neoplasia prostática em determinado período) pode ser em torno de 80 - 90% na doença estritamente localizada e 50 - 70% na doença que apresenta alguma progressão local, em um intervalo de seguimento de 5 anos a 10 anos. Fatores como o PSA inicial e após o tratamento, resposta ao tratamento, pontuação de gleason, aspectos cirúrgicos (como margem da próstata após a prostatectomia radical e presença de linfonodos acometidos) podem influenciar tanto na sobrevida global como a câncer específica.
| Estágio da doença | Sobrevida global | Recorrência |
|---|---|---|
| Doença localizada | 99% | 80-90% |
| Localmente avançada | 98% | 50-70% |
| Doença metastática | 35% | 30%* |
Sobrevida global: avaliação dentro de 5 anos quantos pacientes seguem vivos após o diagnóstico da neoplasia da próstata, relacionado às múltiplas causas de óbito.
Recorrência: avaliada no intervalo de 5 a 10 anos.
*Neste caso estamos avaliando progressão apesar do tratamento inicial da doença metastática
O Dr Romulo Nunes é médico graduado pela Faculdade de Medicina da USP, urologista formado pelo Hospital das Clínicas da USP, realizando durante sua residência estágios internacionais na Inglaterra (Guy`s Hospital) e Itália (Hospital San Raffaele), ano adicional no departamento de transplante renal do Hospital das Clínicas da USP. Possui certificação em cirurgia robótica pela Sociedade Brasileira de Urologia e realizou Fellowship em cirurgia robótica e minimamente invasiva na Bélgica (OLV hospital / ORSI academy) no principal e um dos centros pioneiros de formação em cirurgia robótica da Europa, sendo capacitado para realização de tratamentos cirúrgicos avançados no tratamento do câncer de próstata.
Detém participação em congressos internacionais como ouvinte e discutidor. Atualmente participa de projetos de pós-graduação pela Universidade de São Paulo, é médico colaborador do Instituto do Câncer do Estado de São Paulo e é membro do corpo clínico dos principais hospitais de São Paulo.
Sugerimos a você realizar consulta ou orientar os familiares caso estejam na faixa etária de risco, busque saber mais detalhes para prevenção e seguimento, tenha suspeita ou já necessite de tratamento para o câncer de próstata.
1) Ficarra, V., Novara, G., Ahlering, T. E., Costello, A., Eastham, J. A., Graefen, M., Guazzoni, G., Menon, M., Mottrie, A., Patel, V. R., Van der Poel, H., Rosen, R. C., Tewari, A. K., Wilson, T. G., Zattoni, F., & Montorsi, F. (2012). Systematic review and meta-analysis of studies reporting potency rates after robot-assisted radical prostatectomy. European urology, 62(3), 418–430.https://doi.org/10.1016/j.eururo.2012.05.046
2) Nahas WC, Rodrigues GJ, Rodrigues Gonçalves FA, Sawczyn GV, Barros GG, Cardili L, et al. Perioperative, Oncological, and Functional Outcomes Between Robot-Assisted Laparoscopic Prostatectomy and Open Radical Retropubic Prostatectomy: A Randomized Clinical Trial. Journal of Urology [Internet]. 2024 Jul 1 [cited 2024 Jul 30];212(1):32–40.https://doi.org/10.1097/JU.0000000000003967
3) Cornford, P., van den Bergh, R. C. N., Briers, E., Van den Broeck, T., Brunckhorst, O., Darraugh, J., Eberli, D., De Meerleer, G., De Santis, M., Farolfi, A., Gandaglia, G., Gillessen, S., Grivas, N., Henry, A. M., Lardas, M., van Leenders, G. J. L. H., Liew, M., Linares Espinos, E., Oldenburg, J., van Oort, I. M., … Tilki, D. (2024). EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer-2024 Update. Part I: Screening, Diagnosis, and Local Treatment with Curative Intent. European urology, 86(2), 148–163. https://doi.org/10.1016/j.eururo.2024.03.027
4) Instituto Nacional do Cancer, Cancer de Próstata. https://www.gov.br/inca/pt-br/assuntos/cancer/tipos/prostata
5) John Hopkins Medicine Institute, Prostate Cancer Treatment, https://www.hopkinsmedicine.org/health/conditions-and-diseases/prostate-cancer/prostate-cancer-treatment
*Respeitamos a sua privacidade e não enviamos spam.
Cuide da sua saúde com quem é referência em urologia. Entre em contato e agende sua consulta agora mesmo.